-
二氧化硫 编辑
二氧化硫(Sulfur Dioxide)是最常见、最简单的硫氧化物,化学式SO2,大气主要污染物之一,且属世界卫生组织国际癌症研究机构公布的3类致癌物之一。
它是无色气体,有强烈刺激性气味。火山爆发时会喷出该气体,在许多工业过程中也会产生二氧化硫。
目录
- 1 基本信息
2 理化性质
3 使用限量
4 应用领域
5 风险解析
6 相关术语
7 接触控制
8 注意事项
9 运输信息
10 法律法规
11 危害防范
12 检测方法
13 常见谣言
基本信息
编辑中文名:二氧化硫
化学式:SO₂
CAS登录号:7446-09-5
熔点:-75.5 ℃
水溶性:易溶于水
外观:无色气体
应用:化学
危险性描述:不燃。若遇高热,容器内压增大,有开裂和爆炸的危险
环境危害:对大气可造成严重污染
电解性:属于非电解质
英文名:sulfur dioxide
分子量:64.0638
EINECS登录号:231-195-2
沸点:-10 ℃
密度:2.9275kg/Nm3
闪点:无
危险性符号:有毒性
管制类型:管制
毒性:有毒
颜色:无色
理化性质
编辑物理性质
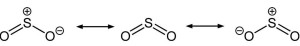 二氧化硫的三种共振结构
二氧化硫的三种共振结构
液态二氧化硫比较稳定,不活泼。气态二氧化硫加热到2000℃不分解。不燃烧,与空气也不组成爆炸性混合物。
无机化合物如溴、三氯化硼、二硫化碳、三氯化磷、磷酰氯、氯化碘以及各种亚硫酰氯化物都可以任何比例与液态二氧化硫混合。碱金属卤化物在液态二氧化硫中的溶解度按I->Br->Cl-的次序减小。金属氧化物、硫化物、硫酸盐等多数不溶于液态二氧化硫。
二氧化硫是一个弯曲的分子,其对称点群为C2v。硫原子的氧化态为+4,形式电荷为0,被5个电子对包围着,因此可以描述为超价分子。从分子轨道理论的观点来看,可以认为这些价电子大部分都参与形成S-O键。二氧化硫中的S-O键长(143.1 pm)要比一氧化硫中的S-O键长(148.1 pm)短,而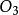 中的O-O键长(127.8 pm)则比氧气
中的O-O键长(127.8 pm)则比氧气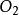 中的O-O键长(120.7 pm)长。二氧化硫的平均键能(548 kJ·mol-1)要大于S-O的平均键能(524 kJ·mol-1),而
中的O-O键长(120.7 pm)长。二氧化硫的平均键能(548 kJ·mol-1)要大于S-O的平均键能(524 kJ·mol-1),而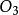 的平均键能(297 kJ·mol-1)则小于O2的平均键能(490 kJ·mol-1)。这些证据使化学家得出结论:二氧化硫中的S-O键的键级至少为2,与臭氧中的O-O键不同,臭氧中的O-O键的键级为1.5。
的平均键能(297 kJ·mol-1)则小于O2的平均键能(490 kJ·mol-1)。这些证据使化学家得出结论:二氧化硫中的S-O键的键级至少为2,与臭氧中的O-O键不同,臭氧中的O-O键的键级为1.5。
分子结构与极性:V形分子,极性分子。
pH:2/3的二氧化硫溶于水生成亚硫酸(H2SO3),溶液的pH值变成2或3。
25℃时二氧化硫在空气中的扩散系数:1.15*e-5(m2/s)。


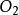 (g) =点燃=
(g) =点燃=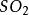 (g)
(g)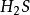
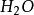 (g) + 2
(g) + 2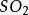 (g)
(g) 实验步骤
实验步骤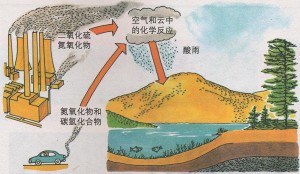
 生成二氧化硫
生成二氧化硫 酸雨腐蚀后的森林
酸雨腐蚀后的森林 二氧化硫检测仪
二氧化硫检测仪



















